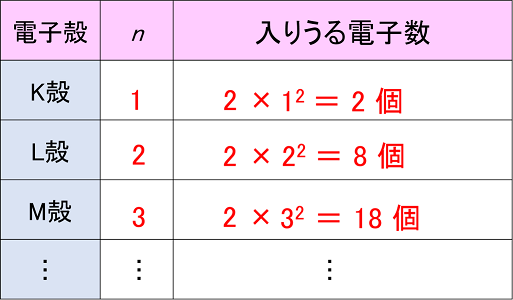
[最も共有された! √] 価電子 表 177552-最外殻電子 価電子 表
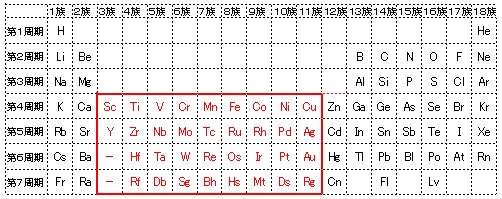
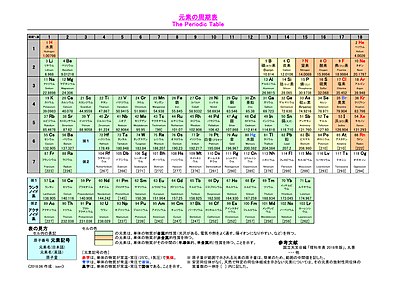
価電子を記号・で表した表記法 1 2 13 14 15 16 17 Li Be B C NOF 不対電子 P14 電子式と価電子・原子価 原子価:不対電子の数:手の数 P14 イオン(陽イオン) 原子が電子を放出すると陽イオンになる Na →Na eナトリウム ナトリウムイオン イオン式 Al3 (アルミニウムイオン)第7回 元素の周期表 電子配置と周期表 元素を原子番号の順に 並べていくと,( ) の数は規則的に変化する。 そのほかにも,単体の融点など, さまざまな性質が規則的に変化 する。元素の( ) 2 周期律 図 価電子の数の変化 価電子 周期表 縦の列元素 価電子数 表 周期表 Wikipedi 電子軌道周期表 周期 族または元素名 軌道名 1 1と18 1s 2 1と2 2s 1318 2p 3 1と2 3s 1318 3p 4 1と2 4s 312 3d 1318 4p 5 1と2 5s 312 4d 1318 5p 6 1と2 6s ランタノイド元素 4f 312 5d 1318 6p 7 1と2 7s アクチノイド元素 5f 312 族と価電子数を、表にまとめ

希ガスの電子配置は価電子ゼロの閉殻であっていますか Clear
最外殻電子 価電子 表
最外殻電子 価電子 表-H(水素イオン(アルミニウムイオン)Li(リチウムイオン)Ni2 (ニッケルイオン)Na (ナトリウムイオン)Fe3 (鉄(III)イオン)K(カリウムイオン)Cu2 (銅(II)イオン)Mg2(マグネシウムイオン)Zn2(亜鉛イオン)Ca2(カルシウムイオン)Cd2(カドミウムイオン)Ba2(バリウムイオン)Hg2 (水銀(II)イオン)Cの価電子数= 4 (2s22p2) 例)CO2 1)分子の総価電子数(V)を計算する = 4 (2s Oの価電子数= 6 (2s22p4) 総価電子数 = 42x6 = 16 2)共有結合の数(Nb)を計算する イオンの場合は電荷に応じて増(陰イオン) 減(陽イオン)する Nbc = (8x316)/2 = 4 n原子分子なら Ncb = (8nV)/2




価電子数と同じ電子配置の希ガス原子をどう求めるのかわかりません Clear
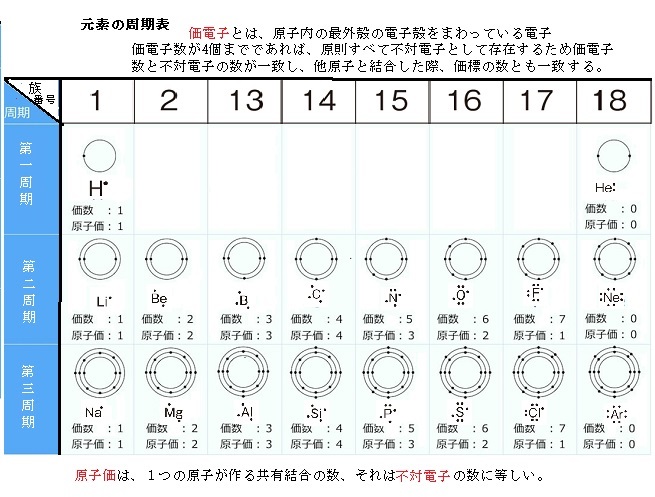
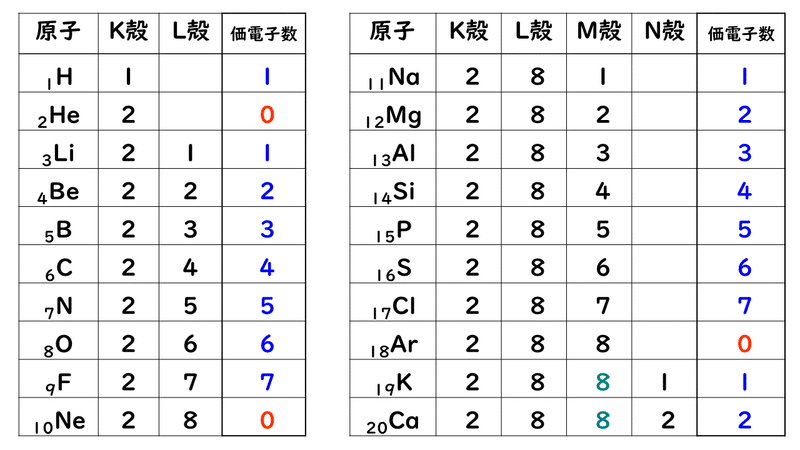
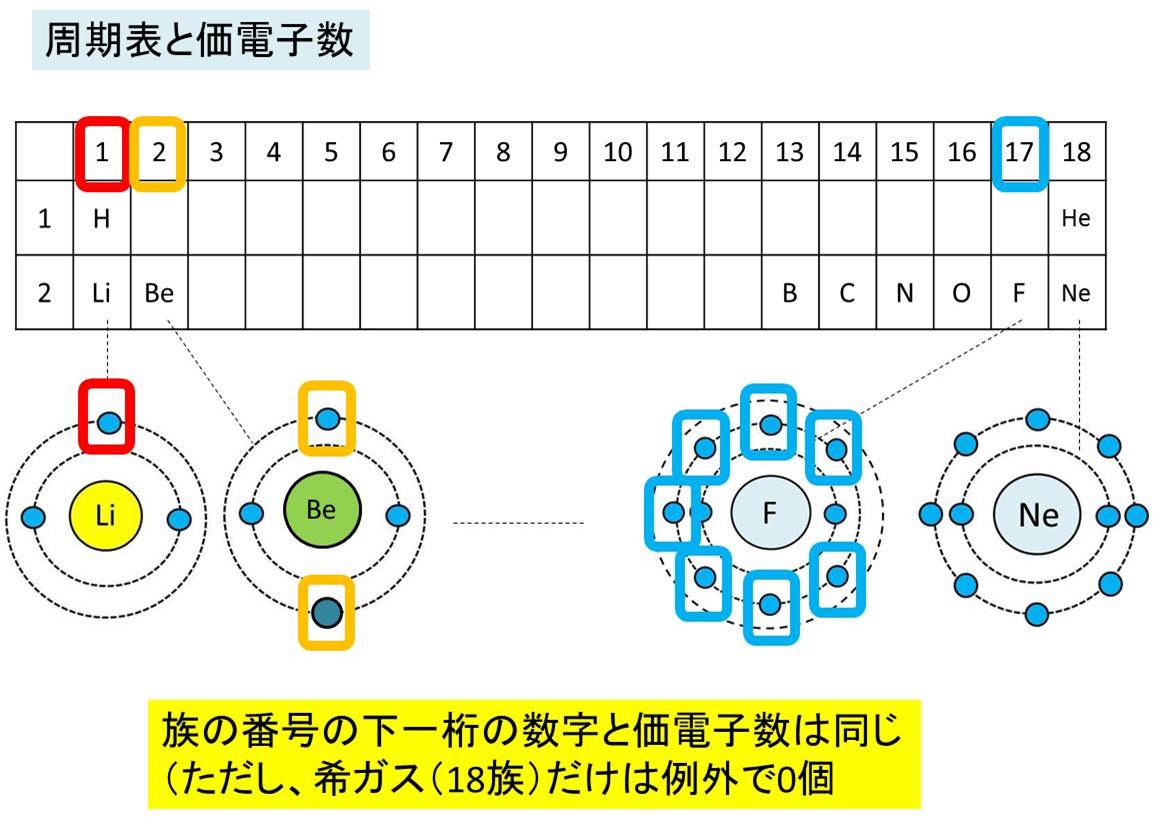
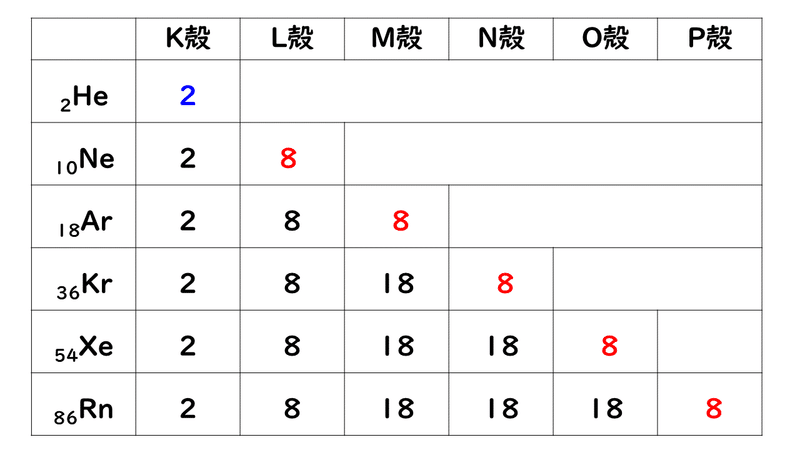
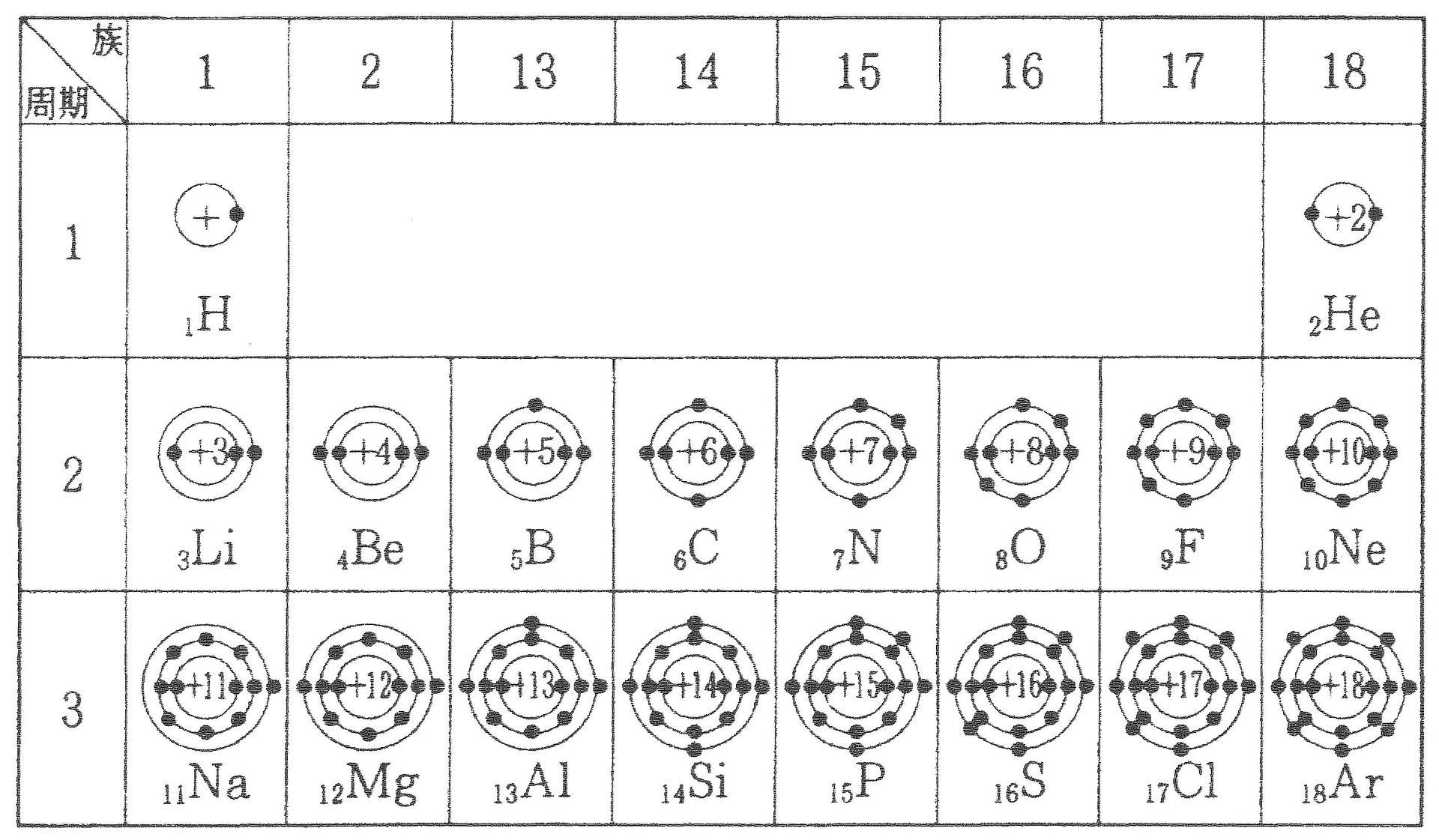
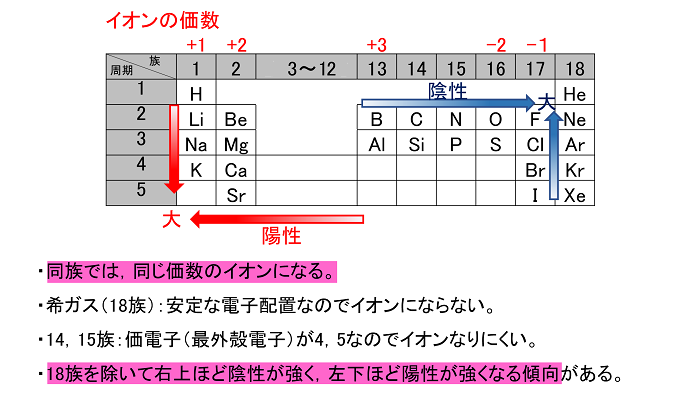
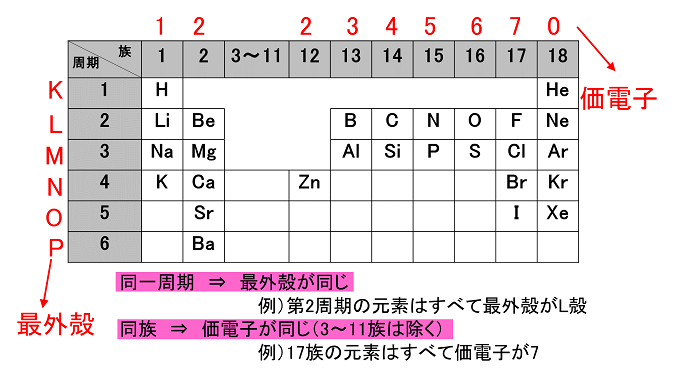
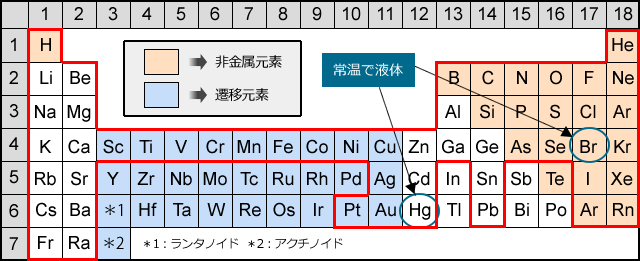
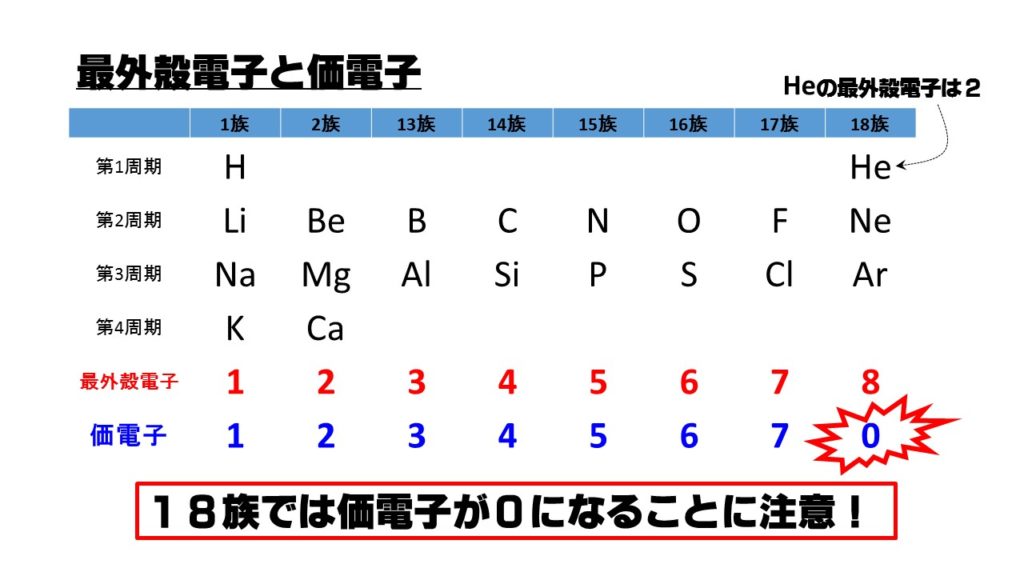
例えば,周期表の 1族の元素の原子はどれも価電子の数が1個ですが,このうちLi,Na,K,Rb,Cs はどれも金属元素で,1価の陽イオンになりやすく,酸化されやすく,水と反応しやすいなど,よく似た性質をもっています(これらの元素をアルカリ金属元素といいます)。 17族の元素 F,Cl,Br,I の原子は価電子の数が7個で,1価の陰イオンになりやすく,金属元素と☆ 一般的に、 価電子数 = 最外殻電子数 = 周期表の族の番号の1の位の数 (outermost electron) 例外希ガス(貴ガス)は、価電子数= 0、最外殻電子数= 2 または 8 価電子数が等しい原子は、化学的性質が似ている ☆次の電子配置は安定(重要)「価電子の数 = 最外殻電子の数」となる。 希ガス原子 0 とする。「価電子の数 ≠ 最外殻電子の数」となる。 窒素原子 7n とアルゴン原子 18 ar について,それぞれ次の問いに答えよ。 問1 k 殻,l 殻,m 殻には,電子がそれぞれ何個入っているか。 問2 価
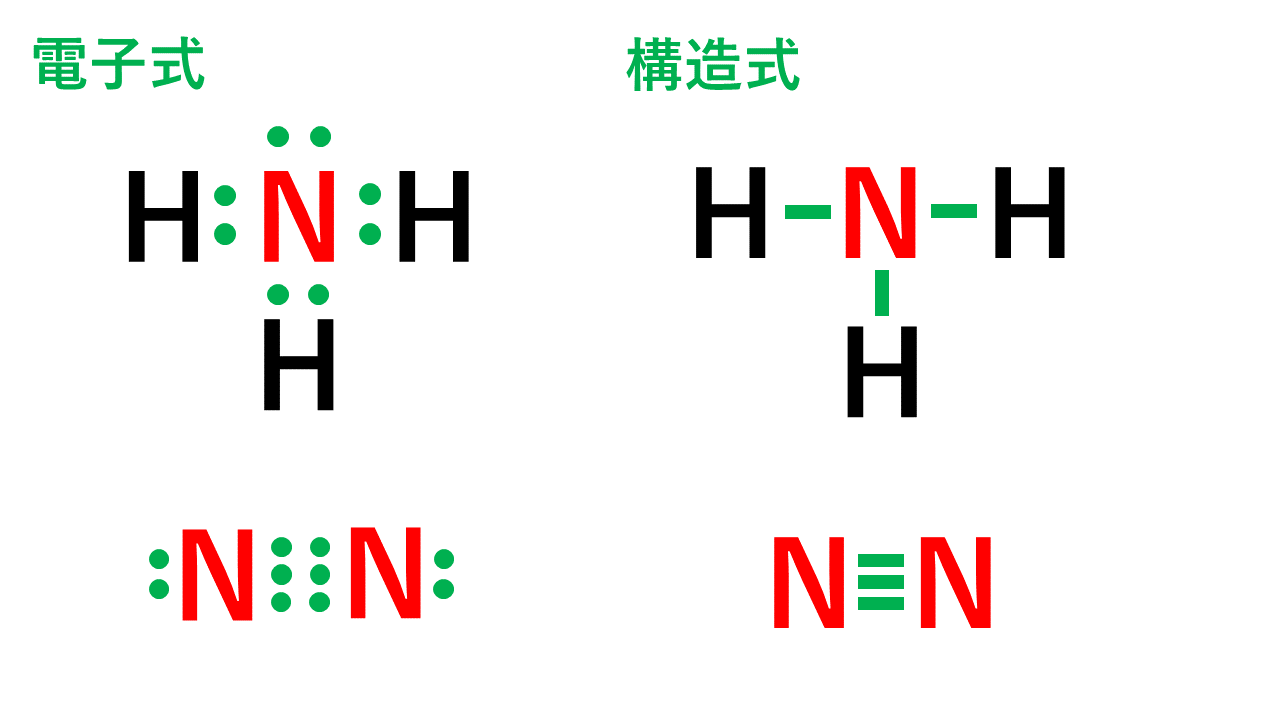
価電子 (オスミウム) Osmium Valence 0 0 21年3月13日土曜日 Edit this post このページでは、私はについて話します価電子 (オスミウム) もっと好奇心を知りたい場合は、このビデオをチェックしてください オスミウム (価電子) 0,3,4,6,8 詳細についてはこちら 価電子 · 下の表を見てみると、縦の列で価電子の数が同じである。 つまり、縦列の原子は似た性質を持っている。 一番右列(18族)の原子は、 最外殻電子の数が8個 となっている。 · 価電子数5つのうち、3つが不対電子となります。 例えば、アンモニアNH 3 の場合、不対電子3つと水素が共有結合し、3本の共有結合が生じます。 窒素原子Nからは、価標(棒線)が3本出ています。 窒素分子N 2 の場合、三重結合となりますが、同様に窒素原子Nからは、価標(棒線)が3本出ています。
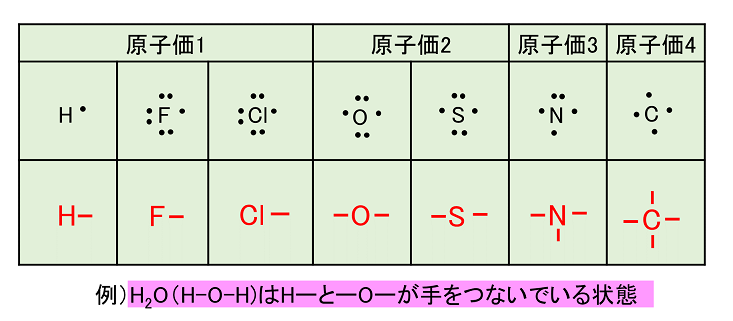
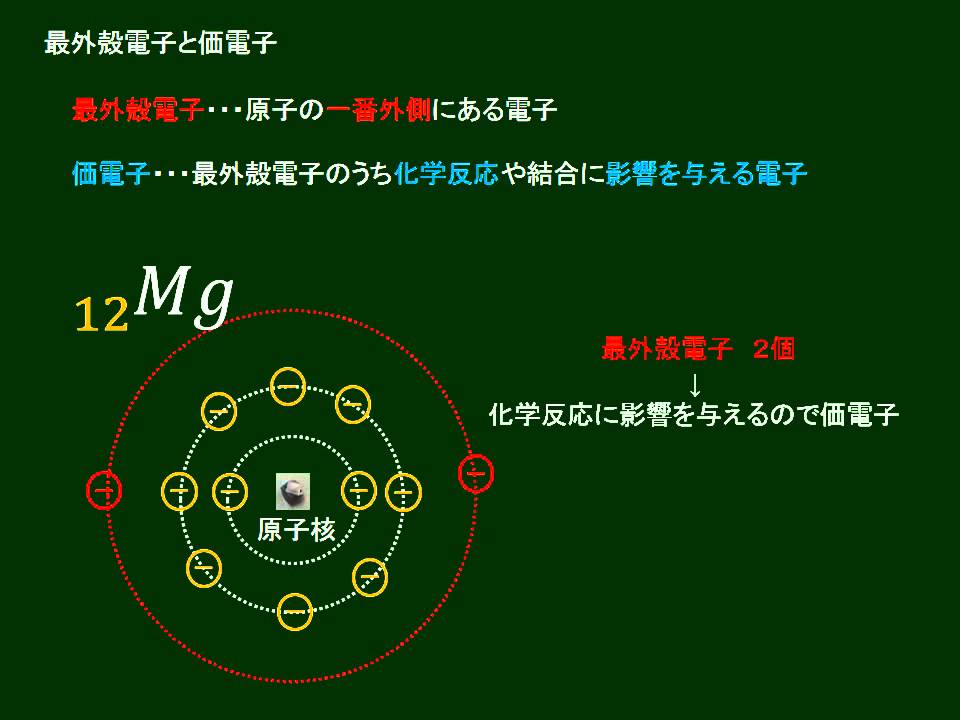
周期表を理解するためには、3つのポイントがあります。 ~ポイント1~ 原子番号が大きくなるに従って、陽子が一つずつ増えていき、それにつれて原子の質量も大きくなります。 ~ポイント2~ 陽子が一つずつ増えていくに従って、電子の数も増えて分子中の原子の「最外殻電子」と「価電子」 分子中の原子について、次のように約束する。 「最外殻電子」:共有している電子を「2個」と数える 「価電子」:共有している電子を「1個」と数える h o h h o h 「最外殻電子」 「価電子」 · 1族や2族に該当するナトリウムNaやカルシウムCaなどは、最外殻電子が1個や2個存在します。18族である希ガスの電子配置は安定的なため、そこに電子を一つや二つ加えただけの1族や2族は簡単に最外殻電子を1個または2個放出でき、一価の陽イオン(Na )や二価の陽イオン(Ca 2 )などになります。



原子とイオン




元素に規則性を見つけたメンデレーエフの周期表をわかりやすく元研究員が解説 ページ 2 3 Study Z ドラゴン桜と学ぶwebマガジン
(c) 最外殻電子 最も外側の電子殻に存在する電子。 価電子 原子が他の原子と結合するときに重要な働きをする電子。一般に,最外殻電 子が価電子として働く。価電子の数が等しい原子どうしは,化学的性質が似ている。 2原子の構成と元素の周期表 13 第 Ⅰ 章 物たとえば塩素の正原子価は-1であるが、逆原子価は+7、硫黄の正原子価は-2、逆原子価は+6で、それらの原子価の絶対値の和は8である。 このことは電子が 化学結合 に関与するとき、その原子の原子価または 原子価電子 の数として8が重要な意味をもつことを示すもととなった重要な規則である( 表周期表とその見方 戻る 性質のよく似た元素が縦の列に並ぶように整理した表を周期表といいいます。 元素の整理 族と周期、同族元素 電子の配置と価電子




価電子とは 価電子数の数え方をやさしく説明するよ 授業 レベルa2 ともよし塾 受験と科学の解説授業




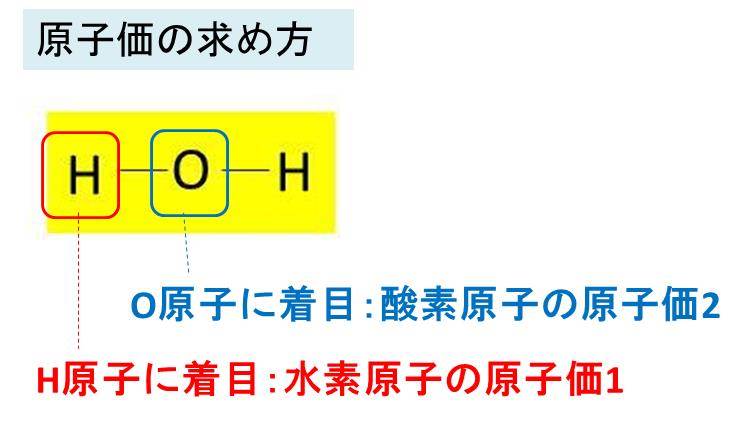
原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ
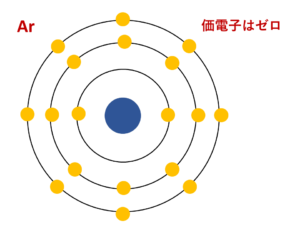
周期表 の 価電子 (ケイ素) Silicon Valence 素材ブログ Gelsonluzcomdd mmmm yyyyです。 URL ここで、dd、mmmm、yyyyを、このページを閲覧した日、月、年に置き換えます。 また、このページの実際のurlのURLを置き換えます。00 · 価電子は基本的には最外殻電子のことですが、 最外殻が閉殻しているまたは最外殻電子が8個のとき、価電子とは呼びません。 そしてこの 最外殻が閉殻しているまたは最外殻電子が8個の原子を希ガス といいます。価電子帯の電子が ンド(伝導帯)に遷移 電子 ホール(正孔) ホール=電子の抜け殻 運動量、エネルギー、 有効質量、電荷 ・・・元の電子に対し、抜け殻 で考えると符号が変わる 伝導帯 価電子帯 t > 0 伝導帯下端 価電子帯上端 106




2 See How To Solve It At Qanda




共有結合を即理解 わかりやすい図で解説 高校生向け受験応援メディア 受験のミカタ
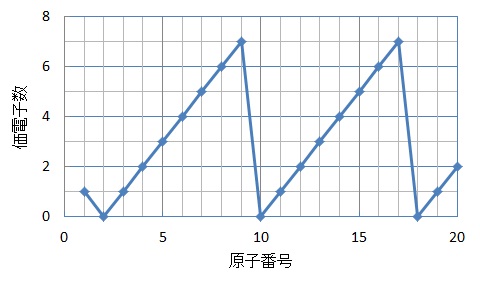
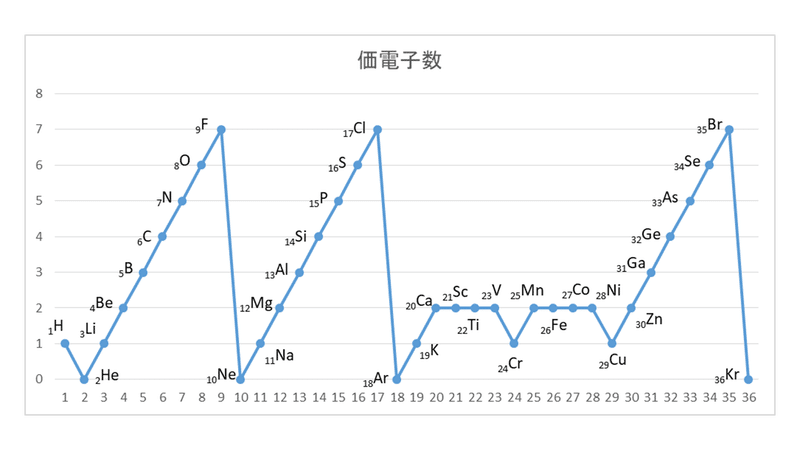
横軸は、 原子番号 になっています。 縦軸は、 価電子の数 になっていますね。 たとえば、原子番号1のH(水素)は、価電子の数が「1」です。 原子番号2のHe(ヘリウム)は、価電子の数が「0」です。 Heは、希ガスだったので、価電子の数は「0」なのですね。 その続きは、次のように順番に増えていきます。 Li(リチウム) 「1」 Be(ベリリウム) 「2」 B周期表で炭素のすぐ下に書かれている元素はケイ素です。ケ イ素の14個の電子は、内側の電子殻から順に2、8、4個入 ります。そうすると、いちばん外側の電子殻の電子(価電子 という)は、炭素元素と同じ4個です。 · 表価(ひょうか)とは。意味や解説、類語。貨幣の表面に記してある価格。額面価格。 goo国語辞書は30万4千件語以上を収録。政治・経済・医学・ITなど、最新用語の追加も定期的に



10 Descubre Como Resolverlo En Qanda



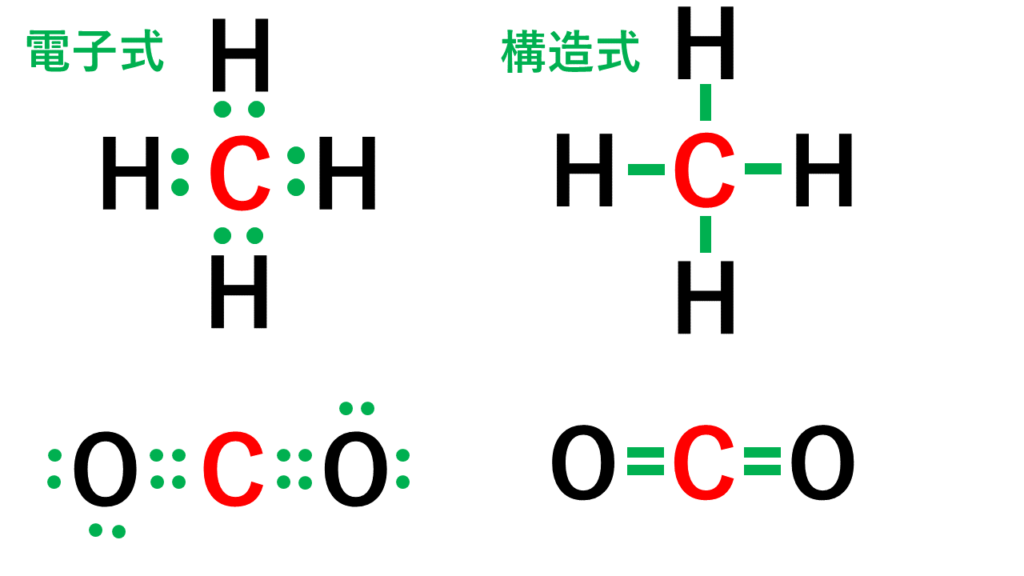
分子と共有結合
電子と同様に核電荷の遮蔽効果が小さい。原子番 号順に核荷電は1単位ずつ増加するが、充填され るf電子による遮蔽効果が小さいので、結果とし て原子番号が増加するに伴い化学的相互作用に関 与する価電子に働く有効核電荷が大きくなり外殻有機金属化学の基礎(第1回) ・周期表 ・形式酸化数、価電子数 ・配位子と結合様式 ・18電子則 ・配位子場理論電子親和力 (電子ボルト) 1156 0557 2128 電気陰性度 (AllredRochow) 175 144 金属結合半径 (pm) 125 138 139 融点 (K) 1728 1805 414 沸点 (K) 3186 3236 4098



2章a 類題1 1 0002 Top A 問題 次の文を読んで下の各問いに答えなさい 物質の基本 ア である元素の形成過程は次のように考えられている イ 億年前の宇宙創生の ウ から数万年後にまず軽元素の エ などが形成され その後 星の誕生 成長 爆発




価標と原子価の違いって 受験に化学を必要とする人へ
最外殻電子のうち,原子がイオンになったり,ほ かの原子と結びついたりするときに,重要な役割を 果たすものを( 価電子 )という。最外殻電子が 1~7 個の場合,価電子の数は最外殻電子の数と等し い。* * He は最外殻電子の数は2 個であるが,価電子の価電子 (例)アルカリ金属 多い (6、7個) ⇒ 陰イオンになりやすい(陰性元素) (例)ハロゲン すると、さらに次のような疑問が湧いてきます。 これまで登場してこなかった、価電子が4個、5個の元素はどうなるんだろう?「価電子」 とは、 最外殻にある1から7個の電子 のことです。 「価電子」と「最外殻電子」はよく似ていますが、 「1から7個」 というところが非常に重要です。 今回のCとFの場合は、どちらも「1から7個」の中に収まっています。




化学 原子の構成 周期表 これを読めば時短で簡単に全部わかる Youneed




高校化学基礎 原子価とは 映像授業のtry It トライイット



なんとなくわかる高校化学 価電子



車山高原レア メモリーが語る 元素の周期表



第2周期元素 Period 2 Element Japaneseclass Jp



エレメンタッチって何 元素の立体周期表 Elementouch エレメンタッチ



1 4 電子殻と電子配置 おのれー Note



価電子 Chemihack おうちで学べる化学



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Mat3 Pdf



価電子とは 数え方や覚え方 最外殻電子との違いは



受験基礎化学 11 共有結合 共有結合結晶 みかみの参考書ブログ




高校化学基礎 周期律と価電子 映像授業のtry It トライイット




希ガスの電子配置は価電子ゼロの閉殻であっていますか Clear



周期表と元素 理科の講義ノート Lecture Notebook



化学講座 第3回 元素の周期表 私立 国公立大学医学部に入ろう ドットコム



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Chem4 Pdf




高校化学基礎 周期律と価電子 映像授業のtry It トライイット




2 希土類元素 ランタノイド



図解 最外殻電子と価電子の定義と違い 結論 希ガスで異なります サイエンスストック 高校化学をアニメーションで理解する



周期律と周期表 覚書




電子式 イオン式から配位結合 錯イオンの仕組みまでわかりやすく解説




環化 原子と元素 周期表 札幌カフェ部 活動報告




原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ




高校化学基礎 周期律と価電子 映像授業のtry It トライイット



周期表 化学基礎 高校化学net参考書



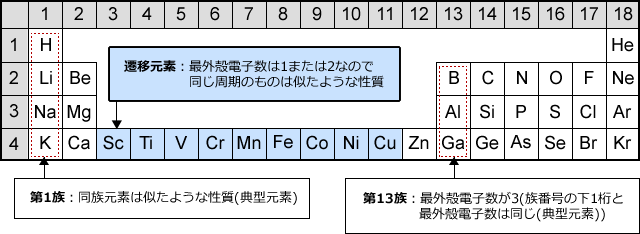
遷移元素の特徴とは 具体的な元素名と性質



原子価の意味と一覧 価電子 価標の違い Vicolla Magazine



1 4 電子殻と電子配置 おのれー Note




原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ




イオン化エネルギー 電子親和力 電気陰性度のグラフの違いを区別せよ 化学受験テクニック塾



3



理論 電子配置と電子軌道 受験 定期テストで高校化学を完全攻略




イオンの構造と電子配置を軌道と共に学ぶ 電荷密度や 安定なイオンの種類についてもわかりやすく解説




価電子数を求める方法 12 ステップ 画像あり Wikihow



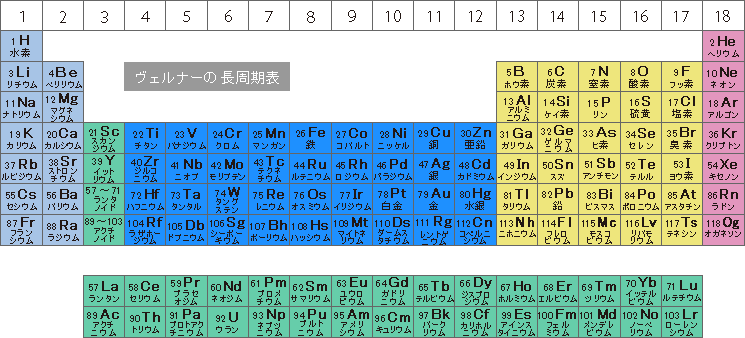
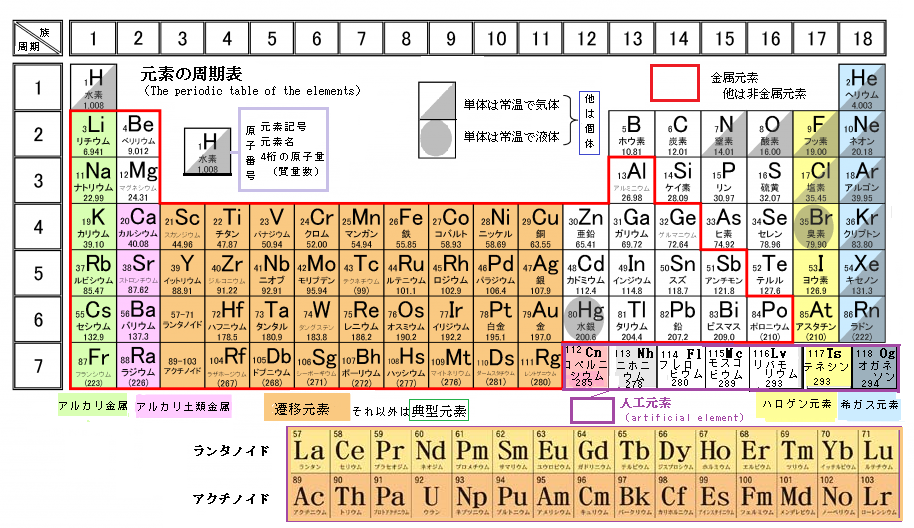
周期表 Wikipedia




โน ตของ 1 2 周期表 その2 ช น Senior High化学 Clear




原子の電子配置と元素の周期表 真実はいつも化学 Nao Chemistry Blog



受験基礎化学 6 電子配置 みかみの参考書ブログ



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Chem4 Pdf



原子とイオン



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Mat3 Pdf



5分でわかる 原子価の意味と一覧 価電子 価標の違い を図で徹底解説 サイエンスストック 高校化学をアニメーションで理解する




遷移元素の特徴 遷移元素のk殻 l殻 m殻 化学 By 藤山不二雄 マナペディア




価電子数を求める方法 12 ステップ 画像あり Wikihow



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Mat3 Pdf




化学基礎 物質の構成 価電子 10分 Youtube



周期表とその見方 戻る 性質のよく似た元素が縦の列に並ぶように整理した表を周期表といいいます 元素の整理 族と周期 同族元素 電子の配置と価電子 価電子とは 最外殻電子の数 4 7 価電子の数 4 7 価電子 最外殻にある1から7個の電子 内側からn




原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ




価電子数と同じ電子配置の希ガス原子をどう求めるのかわかりません Clear
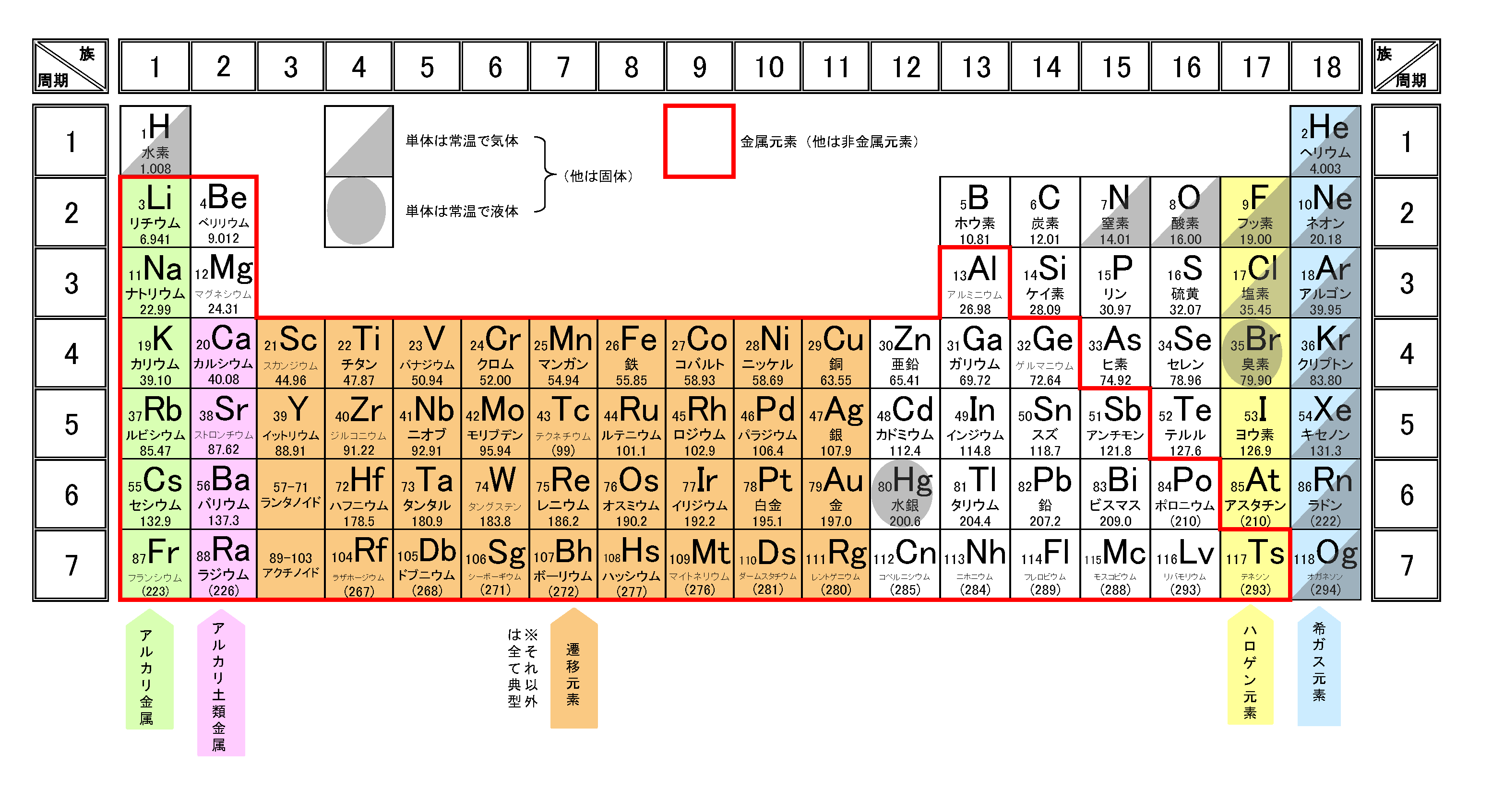



完全版 周期表の語呂合わせの覚え方と族 縦 や周期 横 の見方 サイエンスストック 高校化学をアニメーションで理解する



なんとなくわかる高校化学 周期表 族と周期
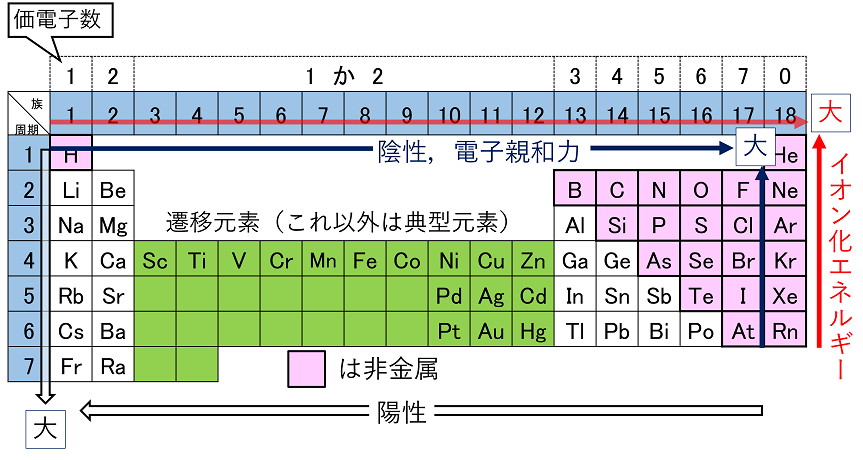



元素の周期表と周期律




Q1 Descubre Como Resolverlo En Qanda




高等学校化学i 物質と原子 Wikibooks




ナノ物質の周期表 の誕生 幾何学的対称性から生まれた新たな理論モデル Academist Journal
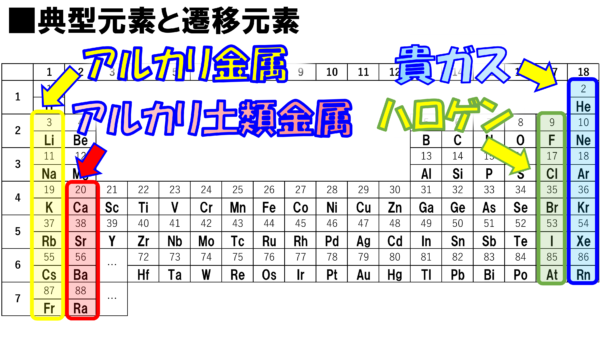



危険物資格取得のための高校化学no 07 元素の周期表 F M サイエンスブログ




価電子と最外殻電子の違いは なぜ一致しない 化学基礎の電子配置の求め方をわかりやすく説明



宮崎技術研究所 の技術講座 電気と電子のお話 4 1 1




高校化学基礎 価電子とは 映像授業のtry It トライイット
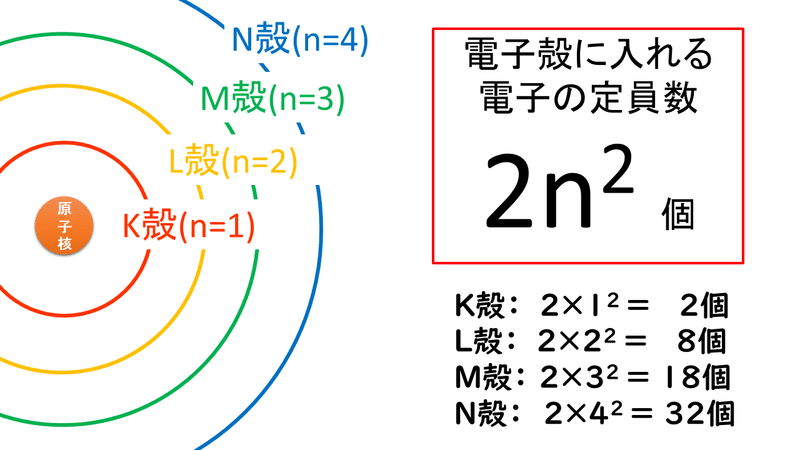



1 4 電子殻と電子配置 おのれー Note




最外殻電子と価電子の違いは 化学受験テクニック塾



1



周期表とその見方 戻る 性質のよく似た元素が縦の列に並ぶように整理した表を周期表といいいます 元素の整理 族と周期 同族元素 電子の配置と価電子 価電子とは 最外殻電子の数 4 7 価電子の数 4 7 価電子 最外殻にある1から7個の電子 内側からn




価電子数を求める方法 12 ステップ 画像あり Wikihow




4 7 Descubre Como Resolverlo En Qanda



Http Oec Chembio Nagoya U Ac Jp Pdfs 17 Orgmet 01 Handout Pdf




化学 化学基礎 補講 Labo



Http Www E Net Nara Jp Hs Gojo Index Cfm 1 1063 C Html 1063 Pdf



イオン



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Chem4 Pdf



Http Heian Gacco Que Jp Haitisyuukikaitou Pdf




原子構造と電子配置 価電子 理系ラボ



化学基礎 最外殻電子と価電子 Youtube



車山高原レア メモリーが語る 元素の周期表




ツで答えが価電子数なのですがなぜですか 最外殻電子数ではないのでしょうか Clear



原子とイオン



1




12 号 触媒 Astamuse



価標 原子価 価電子の違いは




価電子数と同じ電子配置の希ガス原子をどう求めるのかわかりません Clear




価電子とは 周期表との関係 ゼロからの化学基礎



Q Tbn And9gcsehw5cwcaw6di4o3vedvsm7lzfqsols7n4fsxrmqq C2oljibh Usqp Cau



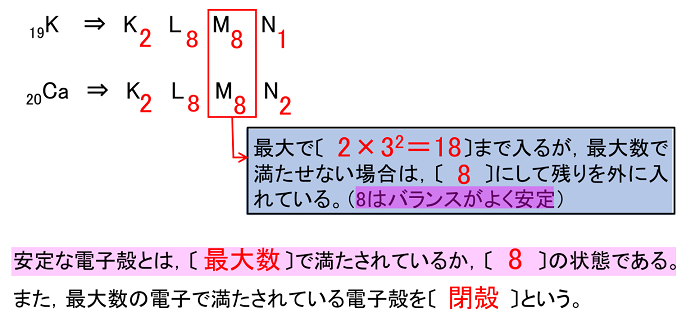
Caの価電子数で 一般にk殻 2 L殻 8 M殻 18となってい Yahoo 知恵袋




Descubre Como Resolverlo En Qanda




目で見て操作する 分子の世界 そのミクロ構造と物性 原子の構造



化学講座 第3回 元素の周期表 私立 国公立大学医学部に入ろう ドットコム



1 6 元素の周期律と周期表 おのれー Note



Numb016



化学重要問題集8 11 原子 イオン Tekibo




原子価の意味と一覧 価電子 価標の違い Vicolla Magazine




5分でわかる 陽イオン 陰イオン 単原子イオン の価数の考え方と覚え方 電子配置を図で解説 サイエンスストック 高校化学をアニメーションで理解する




受験生 高校生必見 周期表の覚え方 スイヘーリーベだけじゃナンセンス めんまのつぶやき



元素の分類 化学基礎 高校化学net参考書




オクテット則 8電子則 大学化学講座


コメント
コメントを投稿